Starke und schwache Säure?

Ihr habt im Alltag bestimmt schon einmal gehört, dass eine Säure sehr stark oder eher schwach ist. Doch woher stammen eigentlich diese unterschiedlichen Säurestärken? Ich glaube jedem ist bewusst, wenn man eine Säure mit Wasser verdünnt, dass dann auch der pH-Wert höher wird. Doch wie sieht es mit zwei gleich stark konzentrierten Säuren aus; haben diese auch immer den gleichen pH-Wert?
Um dies herauszufinden, nehmen wir Essigsäure und Salzsäure mit jeweils einer Konzentration von 1 mol/L und bestimmen den pH-Wert mithilfe eines pH-Messgeräts und Indikatorpapier.
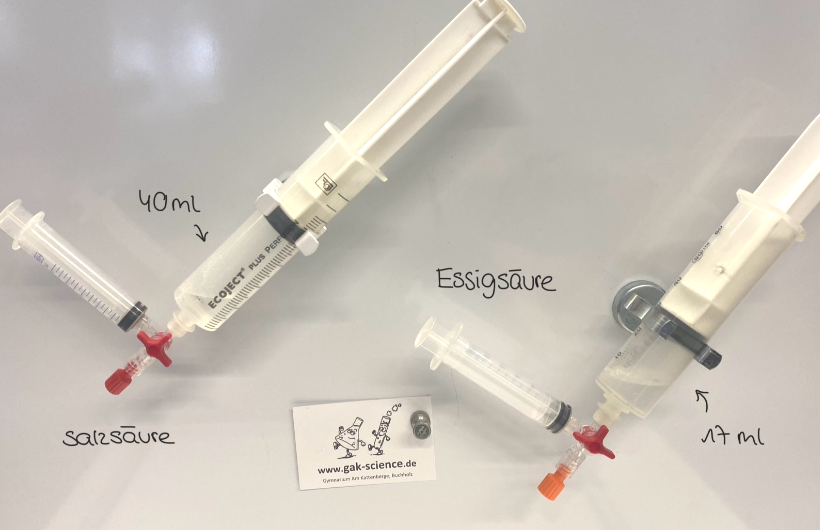
Dabei wird deutlich, dass der pH-Wert von Salzsäure ungefähr 0,1 beträgt und der pH-Wert von Essigsäure bei ungefähr 2,4 liegt. Der pH-Wert und somit auch die Säurestärke sind daher nicht nur von der Anfangskonzentration der Säure abhängig. Um dieses Phänomen nun zu überprüfen, müssen wir einen weiteren Versuch mit den Säuren durchführen. Dafür geben wir in zwei unterschiedliche Spritzen jeweils 10 ml der Säure und verbinden diese jeweils über einen Dreiwegehahn mit einer anderen Spritze, die 2 g Magnesiumband enthält.

Nun drücken wir beide Spritzen, die die Säure enthalten, gleichzeitig und beobachten die Reaktion des Magnesiums mit der Säure. Dabei wird deutlich, dass die Reaktion von Magnesium und Salzsäure wesentlich stärker und schneller abläuft als die Reaktion von Essigsäure mit Magnesium. Dies ist besonders an der unterschiedlich starken Gasbildung zu erkennen. Während bei Salzsäure 40 ml Gas entstehen, sind es bei Essigsäure lediglich 17 ml.
Um diesen Unterschied nun zu erklären, stellen wir zunächst die Reaktiongleichungen auf:
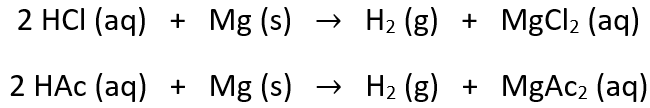
Die Säure reagiert dabei jeweils mit Magnesium zu Wasserstoffgas und zu einem Salz aus Magnesium und dem entsprechenden Säurerest-Ion. Damit wird nun anschaulich, dass für die Reaktion mit Magnesium das Säurerest-Ion in der Lösung der Säure enthalten sein muss. Dies entsteht bei der Protolysereaktion der einzelnen Säuren:
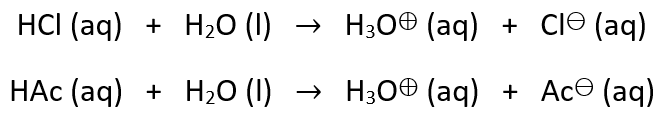
Folglich muss bei der Protolysereaktion von Salzsäure das Gleichgewicht auf Seiten der Produkte und bei Essigsäure das Gleichgewicht auf Seiten der Edukte liegen, damit die vorherigen Beobachtungen bestätigt werden können. Während Salzsäure somit vollständig protolysiert, ist die Protolysereaktion von Essigsäure unvollständig. Das bedeutet, dass die Konzentration des Acetat-Ions somit geringer als die Konzentration der Essigsäure ist. Dadurch kann folglich das Magnesium nur langsam mit den vereinzelten Acetat-Ionen reagieren und die Reaktion dauert länger. Auf diese Weise entsteht der Unterschied in der Säurestärke.
Außerdem erklärt dies auch die unterschiedlichen pH-Werte, da der pH-Wert über die Konzentration der Hydronium-Ionen bestimmt wird. Wenn eine Säure vollständig protolysiert, dann wird auch die Konzentration der Hydronium-Ionen höher und je höher die Konzentration der Hydronium-Ionen ist, desto geringer ist der pH-Wert und desto stärker ist die Säure.
Zusammengefasst bedeutet das, dass eine schwache Säure unvollständig protolysiert und eine starke Säure vollständig protolysiert. Das ist ja gar nicht so kompliziert! 😉