Chemisches Gleichgewicht abhängig von Temperatur

Hast du schon einmal vom Prinzip von Le Chatelier gehört? Nein? Es besagt, dass wenn das chemische Gleichgewicht durch Temperatur-, Konzentrations- und Druckänderungen gestört wird, es sich so verschiebt, dass die Störung vermindert wird. Dieses Prinzip haben wir letztens im Chemieunterricht in Jg. 12 mit Hilfe von Experiment nachgewiesen. Ich stelle euch das Experiment zur Temperaturabhängigkeit vor.
Zur Durchführung des Experiments benötigt man zwei 60 mL Spritzen, in der einen 30 mL Kohlenstoffdioxid und in der andren 25 mL abgekochtes, gasfreies Wasser, einen Dreiwegehahn und ein Thermometer. Durch den Dreiwegehahn wird das Kohlenstoffdioxid zum Wasser gedrückt, danach wird die leere Spritze entfernt. In dem die Spritze mit dem Wasser geschüttelt wird löst sich das Gas, nun wird das Restgasvolumen abgelesen. Um die Abhängigkeit von der Temperatur zu überprüfen, wird der Versuch mehrmals mit unterschiedlichen warmen Wasser durchgeführt, hierfür wird das Thermometer benötigt.
Dabei lässt sich beobachten, dass je höher die Temperatur des Wassers ist, desto mehr Restgasvolumen ist vorhanden. Diese Beobachtung lässt sich mit Hilfe des Le-Chatelier-Prinzips erklären. Wenn die Wassertemperatur erhöht wird, handelt es sich um eine Änderung der Reaktionsbedingungen. Da die Reaktion zwischen Kohlenstoffdioxid und Wasser exotherm ist, verschiebt eine Erhöhung der Temperatur das Gleichgewicht nach links, um die zusätzliche Wärme zu kompensieren. Das heißt, es wird mehr Kohlenstoffdioxid und Wasser aus der Kohlensäure-Reaktion erzeugt, dies führt zum Anstieg des Restgasvolumens in der Spritze. Das ist der Nachweis vom Le-Chatelier-Prinzip, da das System auf die Temperaturerhöhung reagiert, um das chemische Gleichgewicht zu verschieben.
Die Reaktionsgleichung des Experiments ist Folgende:
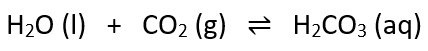
Nun kennst du das Experiment zum Nachweis, dass das chemische Gleichgewicht von Temperatur abhängig und somit die Aussage des Prinzips von Le Chatelier richtig ist.